MECÃNICA ESTRUTURAL DIMENSIONAL CATEGORIAL GRACELI.
SISTEMA DINÃMICO ESTRUTURAL TRANSFORMATIVO INTERATIVO DE FORÇAS FUNDAMENTAIS E ENERGIAS, E DO SISTEMA DIMENSIONAL CATEGORIAL DE GRACELI QUE DETERMINAM E REFERENCIAM O MUNDO DOS FENÔMENOS FÍSICOS, QUÍMICOS, BIOLÓGICOS E PSÍQUICOS .
COMO FORMAS DE INTERAÇÕES ENTRE MOLÉCULAS, ESTRUTURA MOLECLAR, ONDAS, ENRGIAS, PARTÍCULAS, FÓTONS, MOMENTUM MAGNÉTICO, DISTRIBUIÇÃO ELETRÔNICA, NÍVEIS DE ENERGIAS, NÚMEROS QUÂNTICOS E ESTADOS QUÂNTICOS. E OUTROS.
EQUAÇÃO DE GRACELI.. PARA INTERAÇÕES DE ONDAS E INTERAÇÕES DAS FORÇAS FUNDAMENTAIS.
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
1 / G* = = [ ] ω , , / T] c [ [x,t] ] [-1] =
G* = = OPERADOR DE GRACELI = Em mecânica quântica, o OPERADOR DE GRACELI [ G* =] é um operador cujo observável corresponde à ENERGIA TOTAL DO SISTEMA , TODAS AS INTERAÇÕES INCLUINDO TODAS AS INTERAÇÕES DAS FORÇAS FUNDAMENTAIS [AS QUATRO FORÇAS] [ELETROMAGNÉTICA, FORTE, FRACA E GRAVITACIONAL], INTERAÇÕES SPINS-ÓRBITAS, ESTRUTURRA ELETRÔNICA DOS ELEMENTOS QUÍMICOS, TRANSFORMAÇÕES, SISTEMAS DE ONDAS QUÂNTICAS, MOMENTUM MAGNÉTICO de cada elemento químico e partícula, NÍVEIS DE ENERGIA , número quântico , e o sistema GENERALIZADO GRACELI.
COMO TAMBÉM ESTÁ RELACIONADO A TODO SISTEMA CATEGORIAL GRACELI, TENSORIAL GRACELI DIMENSIONAL DE GRACELI..
Em termodinâmica, o efeito Joule-Thomson ou efeito Joule-Kelvin ou efeito Kelvin-Joule descreve a variação da temperatura de um gás ou líquido quando ele é forçado a passar através de uma válvula ou tampão poroso, enquanto mantido isolado, de modo que nenhum calor seja trocado com o ambiente.[1][2][3] Este procedimento é chamado de processo de estrangulamento ou válvula Joule-Thomson.[4] À temperatura ambiente, todos os gases, exceto hidrogênio, hélio e neônio, resfriam-se sob a expansão do experimento de Joule-Thomson.[5][6]
O efeito tem esse nome em homenagem a James Prescott Joule e William Thomson, o 1º Barão Kelvin, que descobriram-no em 1852, na sequência de trabalhos anteriores de Joule sobre a expansão de Joule, em que um gás sofre expansão livre no vácuo.
Descrição
A expansão adiabática (sem troca de calor) de um gás pode ser realizada de várias maneiras. A mudança de temperatura experimentada pelo gás durante a expansão depende não só das pressões inicial e final, mas também da maneira como a expansão é realizada.
- Se o processo de expansão é reversível, o que significa que o gás está em equilíbrio termodinâmico em todos os instantes, ela é chamada expansão isentrópica. Neste cenário, o gás realiza trabalho positivo durante a expansão, e sua temperatura diminui.
- Em uma expansão livre, por outro lado, o gás não realiza trabalho e não absorve calor, assim a energia interna é conservada. Expandido livremente, a temperatura de um gás ideal deveria permanecer constante, mas a temperatura de um gás real pode aumentar ou diminuir, dependendo da temperatura e pressão iniciais.
- O método de expansão discutido neste artigo, no qual um gás ou líquido a uma pressão P1 flui para uma região à baixa pressão P2 através de uma válvula ou tampão poroso, sob condições estáveis e sem variação na energia cinética, é chamada de experimento de Joule-Thomson . Durante este processo, a entalpia permanece inalterada (veja a demostração abaixo).
O processo de estrangulamento ocorre ao longo de uma curva à entalpia constante, no sentido em que a pressão diminui, o que significa que o processo ocorre da esquerda para a direita em um diagrama T-P. À medida que avançamos ao longo de uma curva de entalpia constante, a altas pressões, a temperatura aumenta, até a temperatura de inversão. Então, como o líquido continua a se expandir, a temperatura cai. Se fizermos isso para várias curvas de entalpia constante e juntarmos os pontos de inversão, uma curva chamada de curva de inversão é obtida. Esta curva intercepta o eixo T em alguma temperatura, chamada de temperatura de inversão máxima. Para o hidrogênio, a temperatura é -68°. Na refrigeração por compressão de vapor, é preciso regular a pressão do gás e resfriá-lo ao mesmo tempo. Isto representa uma barreira para as substâncias cuja temperatura de inversão máxima está bem abaixo da temperatura ambiente. Assim, o hidrogênio precisa ser resfriado abaixo de sua temperatura de inversão se o resfriamento é obtido através do estrangulamento.
O mecanismo físico
Uma vez que o gás se expande, a distância média entre as moléculas aumenta. Devido às forças atrativas intermoleculares (ver força de van der Waals), a expansão produz um aumento na energia potencial do gás. Se nenhum trabalho externo é extraído no processo e nenhum calor é transferido, a energia total do gás permanece a mesma por causa da conservação da energia. O aumento da energia potencial, portanto, implica numa diminuição da energia cinética e portanto uma diminuição de temperatura.
Um segundo mecanismo tem o efeito oposto. Durante as colisões com as moléculas do gás, a energia cinética é temporariamente convertida em energia potencial. Como a distância média intermolecular aumenta, há uma queda no número de colisões por unidade de tempo, o que provoca uma diminuição da energia potencial média. Mais uma vez, a energia total é conservada, então isto leva a um aumento na energia cinética (temperatura). Abaixo da temperatura de inversão de Joule-Thomson, o efeito anterior (o trabalho interno realizado contra as forças atrativas intermoleculares) predomina, e a expansão livre provoca uma diminuição na temperatura. Acima da temperatura de inversão, as moléculas de gás se movem mais rapidamente e assim colidem com mais freqüência, e o último efeito (colisões reduzidas produzindo diminuição na energia potencial média) predomina: a expansão de Joule-Thomson provoca um aumento da temperatura.
O coeficiente de Joule-Thomson
A taxa de variação da temperatura T em relação à pressão P em um processo de Joule-Thomson (isto é, à entalpia constante H) é o coeficiente de Joule-Thomson . Este coeficiente pode ser expresso em termos do volume molar V do gás, da sua capacidade térmica à pressão constante e de seu coeficiente de expansão térmica como:[1][3][7]
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
Veja a dedução do coeficiente de Joule-Thomson (Kelvin) abaixo, para a demonstração desta relação. O valor de é normalmente expresso em °C/bar (SI units: K/Pa) e depende do tipo de gás, da temperatura e da pressão do gás antes da expansão. A sua dependência com a pressão normalmente é apenas uma pequena percentagem para pressões até 100 bar.
Todos os gases reais têm um ponto de inversão no qual o valor de muda de sinal. A temperatura ndeste ponto, a temperatura de inversão de Joule-Thomson, depende da pressão do gás antes da expansão.
Numa expansão a pressão diminui, assim o sinal de é negativo por definição. Com isso em mente, a tabela a seguir mostra quando o efeito Joule-Thomson resfria ou aquece um gás real:
| Se a temperatura do gás está | então é | desde que é | assim deve ser | logo o gás |
|---|---|---|---|---|
| abaixo da temperatura de inversão | positivo | sempre negativo | negativo | é resfriado |
| acima da temperatura de inversão | negativo | sempre negativo | positivo | é aquecido |
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
Hélio e hidrogênio são dois gases cujas temperaturas de inversão de Joule-Thomson a uma pressão de 1 atm são muito baixas (por exemplo, cerca de 51 K (-222 °C) para o hélio). Assim, o hélio e o hidrogênio aquecem-se quando expandem-se à entalpia constante à temperatura ambiente típica. Por outro lado, o nitrogênio e o oxigênio, os dois gases mais abundantes na atmosfera, têm temperaturas inversão de 621 K (348 °C) e 764 K (491 °C), respectivamente: estes gases podem ser resfriados à temperatura ambiente pelo efeito Joule-Thomson.[1]
Para um gás ideal, é sempre igual a zero: gases ideais nem se aquecem nem se resfriam ao serem expandidos à entalpia constante.
O efeito Peltier (também conhecido como força eletromotriz de Peltier) é a produção de um gradiente de temperatura na junção de dois condutores (ou semicondutores) de materiais diferentes quando submetidos a uma tensão elétrica em um circuito fechado.
A energia térmica dissipada/absorvida é proporcional à corrente elétrica que percorre o sistema[1], sendo possível assim definir o calor associado pelo efeito com a seguinte equação:
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
onde:
- é calor associado;
- é o coeficiente de Peltier;
- é a corrente elétrica no sistema;
Por ser o reverso do efeito Seebeck, em que ocorre produção de diferença de potencial devido à diferença de temperatura, é possível definir o calor associado no efeito Peltier em termos do coeficiente de Seebeck com a seguinte equação:
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
onde:
- é o coeficiente de Seebeck;
- é a temperatura absoluta do sistema;
Estes dois efeitos podem ser também considerados como um só e denominado de efeito Peltier-Seebeck ou efeito termelétrico. Na verdade, são dois efeitos que podem ser considerados como diferentes manifestações do mesmo fenômeno físico.
A lei de Joule (também conhecida como efeito Joule ou efeito térmico) é uma lei física que expressa a relação entre o calor gerado e a corrente elétrica que percorre um condutor em determinado tempo. Um resistor é um dispositivo que transforma a energia elétrica integralmente em calor.[1][2] O nome é devido a James Prescott Joule (1818-1889) que estudou o fenômeno em 1840 e, um ano mais tarde, publicada na Philosophical Magazine, pela Royal Society.[3]
Definição
Ela pode ser expressa por:[1]
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
onde:
- Q é o calor gerado por uma corrente elétrica percorrendo uma determinada resistência elétrica por determinado tempo;
- I é a corrente elétrica que percorre o condutor com determinada resistência R;
- R é a resistência elétrica do condutor;
- t é a duração ou intervalo de tempo em que a corrente elétrica percorreu ao condutor.
Se a corrente não for constante em relação ao tempo:
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
Termodinâmica
Quando uma corrente elétrica atravessa um material condutor, há produção de calor. Essa produção de calor é devida ao trabalho realizado para transportar as cargas através do material em determinado tempo.
Unidade joule
A lei de Joule está relacionada com a definição de joule onde:
- Um joule é o trabalho realizado para transportar um coulomb (unidade de medida da carga elétrica) de um ponto para outro, estando os dois pontos a uma diferença de potencial de um volt (unidade de medida da diferença de potencial);
- O trabalho é dado por:
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
Onde:
- W é o trabalho elétrico (em joule).;
- Q é a carga (em coulomb);
- U é a diferença de potencial (em volt).
Teoria cinética
A nível molecular o aquecimento acontece por causa da colisão dos elétrons com os átomos do condutor, em que o momento é transferido ao átomo, aumentando a sua energia cinética (ver calor).
Podemos dizer, portanto, que, quando o elétron colide com os átomos, fazem com que os núcleos vibrem com maior intensidade. O grau de agitação molecular é chamado de temperatura, ou seja, quando os elétrons colidem, aumentam a energia cinética dos átomos, sua temperatura.
Efeito de Joule
A passagem da corrente elétrica num condutor provoca o aumento de temperatura liberando calor.[4] A energia elétrica que se transforma em energia calorífica num receptor ou condutor, é diretamente proporcional à resistência elétrica, ao quadrado da intensidade da corrente que o percorre e ao tempo de passagem da corrente. Esta lei é traduzida matematicamente pela seguinte expressão:[4]
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
Em que:
- W - é o trabalho ou a energia dissipada por efeito joule (em joules);
- R - é a resistência elétrica (em ohms);
- I - é a intensidade de corrente que percorre o receptor ou condutor (em ampères);
- t - o tempo de passagem da mesma corrente (em segundos).
Vantagens e inconvenientes
Vantagens
A corrente elétrica ao atravessar um condutor, provoca nele um aumento de temperatura. Este efeito é aproveitado em ferros de passar, aquecedores, soldadores elétricos, secador de mãos, fogões, fornos, iluminação, proteção de instalações elétricas (fusíveis e disjuntores), etc.[4]
Inconvenientes
Em grande parte de aplicações da energia elétrica, a produção de calor correspondente a perdas e em algumas situações pode originar danos mais ou menos graves, nomeadamente quando se verifica um curto-circuito ou maus contatos. Daí há necessidade de utilizar condutores devidamente calibrados para a corrente que vão suportar, bem como prever as proteções e isolamentos convenientes.[5]
Potência dissipada
Nos resistores elétricos pode-se calcular a potência dissipada utilizando a Lei de Joule:
Temperatura Unruh
A temperatura de Unruh é a temperatura efetiva experimentada por um detector uniformemente acelerado em um campo de vácuo, dada por:[6]
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
onde ħ é a constante de Planck reduzida, a é a aceleração local, c é a velocidade da luz, e kB é a constante de Boltzmann. Dessa forma, por exemplo, uma aceleração própria de 2.47×1020 m·s-2 corresponde aproximadamente a uma temperatura de 1 K. Inversamente, uma aceleração de 1 m·s-2 corresponde a uma temperatura de 4.06×10−21 K.[7]
A temperatura de Unruh tem a mesma forma da temperatura de Hawking TH = ħg2πckB para um buraco negro. Tal expressão foi obtida por Stephen Hawking de maneira independente por volta da mesma época. Por isso, tais equações são referenciadas também como Temperatura de Hawking–Unruh.[8]
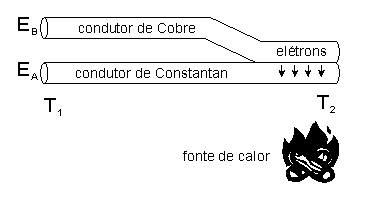
O princípio termoelétrico dos termopares deriva de uma propriedade física dos condutores metálicos submetidos a um gradiente térmico em suas extremidades: a extremidade mais quente faz com que os elétrons dessa região tenham maior energia cinética e se acumulem no lado mais frio, gerando uma diferença de potencial elétrico entre as extremidades do condutor na ordem de alguns milivolts.
Na figura ao lado o valor da força eletromotriz depende da natureza dos materiais e do gradiente de temperatura nos mesmos. Quando o gradiente de temperatura é linear, a diferença de potencial elétrico depende apenas do material e das temperaturas e , (), formalmente representado pela fórmula:
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
onde S é o coeficiente termodinâmico de Seebeck, é a diferença de temperatura e é a diferença de potencial elétrico usualmente medido em milivolts em função da diferença de temperatura (mV/°C).
Quando dois condutores metálicos A e B de diferentes naturezas são acoplados mediante um gradiente de temperatura, os elétrons de um metal tendem a migrar de um condutor para o outro, gerando uma diferença de potencial elétrico num efeito semelhante a uma pilha eletroquímica. Esse efeito é conhecido como Efeito Seebeck sendo capaz de transformar energia térmica em energia elétrica com base numa fonte de calor mediante propriedades físicas dos metais.
A figura ao lado representa dois metais acoplados num dispositivo termopar do tipo T (Cu 100 %; Constantan, Cu 55 %, Ni 45 %). Quando associamos dois metais num termopar, a força eletro motriz gerada é:
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
onde SA e SB são os coeficientes de Seebeck dos metais A e B, T1 e T2 representam a diferença de temperatura na junção dos materiais. Os coeficientes de Seebeck são não-lineares e dependem da temperatura absoluta, material, e da estrutura molecular. Se os coeficientes de Seebeck podem ser considerados efetivamente constantes numa certa gama de temperatura, a fórmula acima pode ser aproximada por:
/
G* = = [ ] ω , , / T] c [ [x,t] ] =
Desse modo é possível obter-se energia elétrica usando-se uma fonte de calor.
/
G* = = [ ] ω , , / T] c [ [x,t] ] =

 =
=




































Comentários
Postar um comentário